I primi 10 alcani. Nomenclatura internazionale degli alcani
In chimica gli alcani sono idrocarburi saturi in cui la catena del carbonio è aperta e costituita da carbonio legato tra loro da singoli legami. Un'altra caratteristica degli alcani è che non contengono affatto doppi o tripli legami. A volte gli alcani sono chiamati paraffine; il fatto è che le paraffine sono in realtà una miscela di carboni saturi, cioè alcani.
Formula degli alcani
La formula dell'alcano può essere scritta come:
In questo caso, n è maggiore o uguale a 1.
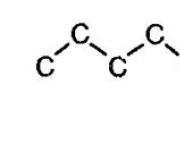
Gli alcani sono caratterizzati dall'isomeria dello scheletro carbonioso. In questo caso le connessioni possono assumere forme geometriche diverse, come ad esempio mostrato nella figura sotto.

Isomeria dello scheletro carbonioso degli alcani
Man mano che la catena del carbonio cresce, aumenta anche il numero di isomeri. Ad esempio, il butano ha due isomeri.

Preparazione degli alcani
L'alcano viene solitamente ottenuto con vari metodi sintetici. Ad esempio, uno dei metodi per produrre un alcano prevede una reazione di “idrogenazione”, quando gli alcani vengono prodotti da carboidrati insaturi sotto l'influenza di un catalizzatore e a temperatura.
Proprietà fisiche degli alcani
Gli alcani si differenziano dalle altre sostanze per la totale mancanza di colore e sono anche insolubili in acqua. Il punto di fusione degli alcani aumenta con l'aumentare del peso molecolare e della lunghezza della catena degli idrocarburi. Cioè, più un alcano è ramificato, maggiore è la sua temperatura di combustione e fusione. Gli alcani gassosi bruciano con una fiamma azzurra o incolore, rilasciando molto calore.
Proprietà chimiche degli alcani
Gli alcani sono sostanze chimicamente inattive, a causa della forza dei forti legami sigma C-C e C-H. In questo caso, i legami C-C sono non polari e i legami C-H sono debolmente polari. E poiché tutti questi sono tipi di legami a bassa polarizzazione che appartengono al tipo sigma, verranno rotti secondo un meccanismo omolitico, a seguito del quale si formano i radicali. Di conseguenza, le proprietà chimiche degli alcani sono principalmente reazioni di sostituzione radicalica.
Questa è la formula per la sostituzione radicale degli alcani (alogenazione degli alcani).
Inoltre, si possono anche distinguere reazioni chimiche come la nitrazione degli alcani (reazione di Konovalov).
Questa reazione avviene ad una temperatura di 140 C, ed è preferibile con un atomo di carbonio terziario.
Cracking degli alcani: questa reazione avviene sotto l'azione di alte temperature e catalizzatori. Quindi si creano le condizioni in cui gli alcani superiori possono rompere i loro legami per formare alcani di ordine inferiore.
DEFINIZIONE
Alcani sono detti idrocarburi saturi, le cui molecole sono costituite da atomi di carbonio e idrogeno legati tra loro solo da legami σ.
In condizioni normali (a 25 oC e pressione atmosferica), i primi quattro membri della serie omologa degli alcani (C 1 - C 4) sono gas. Gli alcani normali dal pentano all'eptadecano (C 5 - C 17) sono liquidi, a partire da C 18 e oltre sono solidi. All’aumentare del peso molecolare relativo, aumentano i punti di ebollizione e di fusione degli alcani. Con lo stesso numero di atomi di carbonio nella molecola, gli alcani ramificati hanno punti di ebollizione inferiori rispetto agli alcani normali. La struttura della molecola di alcano utilizzando il metano come esempio è mostrata in Fig. 1.
Riso. 1. La struttura della molecola di metano.
Gli alcani sono praticamente insolubili in acqua, poiché le loro molecole sono a bassa polarità e non interagiscono con le molecole d'acqua. Gli alcani liquidi si mescolano facilmente tra loro. Si sciolgono bene in solventi organici non polari come benzene, tetracloruro di carbonio, etere etilico, ecc.
Preparazione degli alcani
Le principali fonti di vari idrocarburi saturi contenenti fino a 40 atomi di carbonio sono il petrolio e il gas naturale. Gli alcani con un piccolo numero di atomi di carbonio (1 - 10) possono essere isolati mediante distillazione frazionata del gas naturale o della frazione benzina del petrolio.
Esistono metodi industriali (I) e di laboratorio (II) per produrre alcani.
C + H 2 → CH 4 (kat = Ni, t 0);
CO + 3H 2 → CH 4 + H 2 O (kat = Ni, t 0 = 200 - 300);
CO2 + 4H2 → CH4 + 2H2O (kat, t0).
— idrogenazione degli idrocarburi insaturi
CH 3 -CH=CH 2 + H 2 →CH 3 -CH 2 -CH 3 (kat = Ni, t 0);
- riduzione degli aloalcani
C2H5 I+HI→C2H6+I2 (t0);
- reazioni di fusione alcalina di sali di acidi organici monobasici
C2H5-COONa + NaOH → C2H6 + Na2CO3 (t0);
— interazione degli aloalcani con il sodio metallico (reazione di Wurtz)
2C2H5Br + 2Na → CH3 -CH2 -CH2 -CH3 + 2NaBr;
— elettrolisi dei sali di acidi organici monobasici
2C2H5COONa + 2H2O → H2 + 2NaOH + C4H10 + 2CO2 ;
K(-): 2H2O + 2e → H2 + 2OH - ;
A(+):2C 2 H 5 COO — -2e → 2C 2 H 5 COO + → 2C 2 H 5 + + 2CO 2 .
Proprietà chimiche degli alcani
Gli alcani sono tra i composti organici meno reattivi, il che si spiega con la loro struttura.
Gli alcani in condizioni normali non reagiscono con acidi concentrati, alcali fusi e concentrati, metalli alcalini, alogeni (eccetto fluoro), permanganato di potassio e dicromato di potassio in un ambiente acido.
Per gli alcani le reazioni più tipiche sono quelle che procedono secondo un meccanismo radicalico. La scissione omolitica dei legami C-H e C-C è energeticamente più favorevole della loro scissione eterolitica.
Le reazioni di sostituzione radicalica si verificano più facilmente nell'atomo di carbonio terziario, poi nell'atomo di carbonio secondario e infine nell'atomo di carbonio primario.
Tutte le trasformazioni chimiche degli alcani procedono con la scissione:
1) Legami C-H
— alogenazione (S R)
CH4 + Cl2 → CH3 Cl + HCl ( hv);
CH 3 -CH 2 -CH 3 + Br 2 → CH 3 -CH Br-CH 3 + HBr ( hv).
- nitrazione (S R)
CH 3 -C(CH 3)H-CH 3 + HONO 2 (diluito) → CH 3 -C(NO 2)H-CH 3 + H 2 O (t 0).
— solfoclorurazione (S R)
R-H + SO 2 + Cl 2 → RSO 2 Cl + HCl ( hv).
- deidrogenazione
CH 3 -CH 3 → CH 2 =CH 2 + H 2 (kat = Ni, t 0).
- deidrociclizzazione
CH 3 (CH 2) 4 CH 3 → C 6 H 6 + 4H 2 (kat = Cr 2 O 3, t 0).
2) Legami C-H e C-C
- isomerizzazione (riarrangiamento intramolecolare)
CH 3 -CH 2 -CH 2 -CH 3 →CH 3 -C(CH 3)H-CH 3 (kat=AlCl 3, t 0).
- ossidazione
2CH 3 -CH 2 -CH 2 -CH 3 + 5O 2 → 4CH 3 COOH + 2H 2 O (t 0 , p);
C n H 2n+2 + (1,5 n + 0,5) O 2 → nCO 2 + (n+1) H 2 O (t 0).
Applicazioni degli alcani
Gli alcani hanno trovato applicazione in vari settori. Consideriamo più in dettaglio, usando l'esempio di alcuni rappresentanti delle serie omologhe, così come le miscele di alcani.
Il metano costituisce la base della materia prima per i più importanti processi industriali chimici per la produzione di carbonio e idrogeno, acetilene, composti organici contenenti ossigeno: alcoli, aldeidi, acidi. Il propano è utilizzato come carburante per automobili. Il butano viene utilizzato per produrre butadiene, che è una materia prima per la produzione di gomma sintetica.
Una miscela di alcani liquidi e solidi fino a C 25, chiamata vaselina, viene utilizzata in medicina come base per unguenti. Una miscela di alcani solidi C 18 - C 25 (paraffina) viene utilizzata per impregnare vari materiali (carta, tessuti, legno) per conferire loro proprietà idrofobiche, cioè non bagnabile con acqua. In medicina viene utilizzato per procedure fisioterapeutiche (trattamento con paraffina).
Esempi di risoluzione dei problemi
ESEMPIO 1
| Esercizio | Durante la clorurazione del metano si sono ottenuti 1,54 g di un composto, la cui densità di vapore nell'aria è 5,31. Calcolare la massa di biossido di manganese MnO 2 necessaria per produrre cloro se il rapporto tra i volumi di metano e cloro introdotti nella reazione è 1:2. |
| Soluzione | Il rapporto tra la massa di un dato gas e la massa di un altro gas preso nello stesso volume, alla stessa temperatura e alla stessa pressione è chiamato densità relativa del primo gas rispetto al secondo. Questo valore mostra quante volte il primo gas è più pesante o più leggero del secondo gas. Si considera che il peso molecolare relativo dell'aria sia 29 (tenendo conto del contenuto di azoto, ossigeno e altri gas nell'aria). Va notato che il concetto di "massa molecolare relativa dell'aria" viene utilizzato in modo condizionale, poiché l'aria è una miscela di gas. Troviamo la massa molare del gas formato durante la clorazione del metano: M gas = 29 ×D aria (gas) = 29 × 5,31 = 154 g/mol. Questo è tetracloruro di carbonio - CCl 4. Scriviamo l'equazione di reazione e sistemiamo i coefficienti stechiometrici: CH4 + 4Cl2 = CCl4 + 4HCl. Calcoliamo la quantità di sostanza tetracloruro di carbonio: n(CCl4) = m(CCl4) / M(CCl4); n(CCl4) = 1,54/154 = 0,01 mol. Secondo l'equazione di reazione n(CCl 4) : n(CH 4) = 1: 1, che significa n(CH4) = n(CCl4) = 0,01 mol. Quindi, la quantità di sostanza cloro dovrebbe essere uguale a n(Cl 2) = 2 × 4 n(CH 4), cioè n(Cl2) = 8 × 0,01 = 0,08 mol. Scriviamo l'equazione di reazione per la produzione di cloro: MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O. Il numero di moli di biossido di manganese è 0,08 mol, perché n(Cl 2) : n(MnO 2) = 1: 1. Trova la massa del biossido di manganese: m(MnO2) = n(MnO2) × M(MnO2); M(MnO2) = Ar(Mn) + 2×Ar(O) = 55 + 2×16 = 87 g/mol; m(MnO2) = 0,08 × 87 = 10,4 g. |
| Risposta | La massa del biossido di manganese è 10,4 g. |
ESEMPIO 2
| Esercizio | Determinare la formula molecolare del tricloroalcano, la frazione di massa del cloro in cui è del 72,20%. Redigere le formule di struttura di tutti i possibili isomeri e dare i nomi delle sostanze secondo la nomenclatura sostitutiva IUPAC. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Risposta | Scriviamo la formula generale del tricloroalcheano: C n H 2 n -1 Cl 3 . Secondo la formula ω(Cl) = 3×Ar(Cl) / Mr(C n H 2 n -1 Cl 3) × 100% Calcoliamo il peso molecolare del tricloroalcano: Mr(C n H 2 n -1 Cl 3) = 3 × 35,5 / 72,20 × 100% = 147,5. Troviamo il valore di n: 12n + 2n - 1 + 35,5×3 = 147,5; Pertanto, la formula del tricloroalcano è C 3 H 5 Cl 3. Componiamo le formule di struttura degli isomeri: 1,2,3-tricloropropano (1), 1,1,2-tricloropropano (2), 1,1,3-tricloropropano (3), 1,1,1-tricloropropano ( 4) e 1,2,2-tricloropropano (5). CH2Cl-CHCl-CH2Cl (1); CHCl2-CHCl-CH3 (2); CHCl2-CH2-CH2CI (3); CCl3-CH2-CH3 (4); alcano O paraffina(nome storico, che ha anche altri significati), è un idrocarburo aciclico saturo. In altre parole, un alcano è costituito da atomi di idrogeno e carbonio disposti in una struttura ad albero in cui tutti i legami carbonio-carbonio sono singoli.Gli alcani hanno una formula chimica generale CnH2n+2. Gli alcani variano in complessità dal caso più semplice del metano, CAP 4, dove n = 1 (a volte chiamata molecola originale), a molecole arbitrariamente grandi. Struttura chimica del metano, l'alcano più sempliceA parte questa definizione standard chiamata dall'Unione Internazionale di Chimica Pura e Applicata, nell'uso di alcuni autori il termine alcano si applica a qualsiasi idrocarburo saturo, compresi quelli che sono monociclici (cioè cicloalcani) o policiclici. In un alcano, ciascun atomo di carbonio ha 4 legami (C-C o C-H) e ciascun atomo di idrogeno è attaccato a uno degli atomi di carbonio (come in un legame C-H). La serie più lunga di atomi di carbonio legati in una molecola è nota come scheletro di carbonio o spina dorsale di carbonio. Il numero di atomi di carbonio può essere pensato come la dimensione dell’alcano. Un gruppo di alcani superiori sono le cere, solidi a temperatura e pressione ambiente standard (STAP) per i quali il numero di atomi di carbonio nella catena del carbonio è maggiore, circa 17 volte. Con ripetuto -Canale 2— gli alcani costituiscono una serie omologa di composti organici in cui i gruppi differiscono nel peso molecolare di un multiplo di 14,03 μm (la massa totale di ciascuna unità di metilene, che contiene un singolo atomo di carbonio con una massa di 12,01 μm e due atomi di idrogeno con una massa di 12,01 μm massa di ~ 1,01 μm ciascuno). Gli alcani non sono molto reattivi e hanno poca attività biologica. Possono essere pensati come alberi molecolari su cui possono essere sospesi i gruppi funzionali più attivi/reattivi delle molecole biologiche. Gli alcani hanno due fonti principali: petrolio (petrolio greggio) e gas naturale. Un gruppo alchilico, solitamente abbreviato come R, è un gruppo funzionale che, come un alcano, consiste esclusivamente di atomi di carbonio e idrogeno aciclici legati, come un gruppo metile o etile. Struttura di classificazione
Gli idrocarburi saturi sono idrocarburi che hanno solo legami covalenti singoli tra i loro atomi di carbonio. Possono rappresentare:
Isobutano per 2-metilpropano Proprietà chimiche degli alcani- puoi studiarlo, in una presentazione completa e comprensibile. Proprietà fisiche degli alcaniTutti gli alcani sono incolori e inodori. Tabella degli alcani.
Punto di ebollizione Gli alcani sperimentano le forze intermolecolari di van der Waals. Forze di van der Waals intermolecolari più forti causano punti di ebollizione più elevati degli alcani. Ci sono due fattori determinanti per la forza delle forze di Van Der Waals:
In condizioni standard da CH 4 a C 4 H 10, gli alcani sono gassosi; Da C5H12 a C17H36 sono liquidi; E dopo C 18 H 38 sono solidi. Poiché i punti di ebollizione degli alcani sono determinati principalmente dal peso, non dovrebbe sorprendere che il punto di ebollizione abbia una relazione quasi lineare con la dimensione (peso molecolare) della molecola. Tipicamente, il punto di ebollizione aumenta di 20-30 °C per ogni carbonio aggiunto alla catena. Questa regola vale anche per le altre serie omologhe.
Un alcano a catena lineare avrà un punto di ebollizione più elevato rispetto a un alcano a catena ramificata a causa della maggiore area superficiale in contatto, quindi maggiori forze di van der Waals tra molecole adiacenti. Ad esempio, confronta l'isobutano (2-metilpropano) e l'n-butano (butano), che bollono a -12 e 0 °C, e il 2,2-dimetilbutano e 2,3-dimetilbutano, che bollono a 50 e 58 °C, rispettivamente. In quest'ultimo caso, due molecole di 2,3-dimetilbutano possono "incastrare" insieme meglio del 2,2-dimetilbutano a forma di croce, da qui le grandi forze di van der Waals D'altra parte, i cicloalcani tendono ad avere punti di ebollizione più elevati rispetto alle loro controparti lineari a causa delle conformazioni bloccate delle molecole, che forniscono un piano di contatto intermolecolare. Punti di fusione I punti di fusione degli alcani hanno un andamento simile ai loro punti di ebollizione per lo stesso motivo di cui sopra. Cioè, (a parità di altre condizioni) maggiore è la molecola, maggiore è il punto di fusione. C'è una differenza significativa tra i punti di ebollizione e i punti di fusione. I solidi hanno una struttura più rigida e fissa rispetto ai liquidi. Questa struttura rigida richiede energia per scomporsi. Pertanto, per un migliore legame delle strutture solide, sarà necessaria più energia per rompersi. Per gli alcani, questo può essere visto nel grafico sopra (cioè la linea verde). Gli alcani con numeri dispari hanno una tendenza inferiore a sciogliersi rispetto agli alcani con numeri pari. Ciò è spiegato dal fatto che gli alcani con numero pari si compattano bene nella fase solida, formando una struttura ben organizzata che richiede più energia per rompersi. Gli alcani con numeri dispari si compattano meno bene, e quindi una struttura di compattazione organizzata con una struttura più sciolta richiede meno energia per rompersi. I punti di fusione degli alcani a catena ramificata possono essere più alti o più bassi rispetto ai corrispondenti alcani a catena lineare, sempre a seconda della capacità dell'alcano in questione di accumularsi bene in fase solida: questo è particolarmente vero per gli isoalcani (2-metil isomeri), che spesso hanno temperature di fusione superiori a quelle dei loro analoghi lineari. Conduttività e solubilità Gli alcani non conducono elettricità e non sono polarizzati da un campo elettrico. Per questo motivo non formano legami idrogeno e sono insolubili in solventi polari come l’acqua. Poiché i legami idrogeno tra le singole molecole d'acqua sono allineati lontano dalla molecola dell'alcano, la coesistenza dell'alcano e dell'acqua si traduce in un aumento dell'ordine molecolare (diminuzione dell'entropia). Poiché non esiste una coesione significativa tra le molecole d'acqua e quelle di alcani, la seconda legge della termodinamica suggerisce che questa diminuzione di entropia dovrebbe essere minimizzata minimizzando il contatto tra l'alcano e l'acqua: gli alcani sono detti idrofobi nel senso che respingono l'acqua. La loro solubilità nei solventi non polari è relativamente buona, una proprietà chiamata lipofilicità. Diversi alcani, ad esempio, sono mescolati tra loro in tutte le proporzioni. La densità degli alcani generalmente aumenta con il numero di atomi di carbonio, ma rimane inferiore a quella dell'acqua. Pertanto, gli alcani formano lo strato superiore come miscela alcano-acqua. Geometria molecolare
La struttura molecolare degli alcani influenza direttamente le loro caratteristiche fisiche e chimiche. Deriva dalla configurazione elettronica del carbonio, che ha quattro elettroni di valenza. Gli atomi di carbonio negli alcani sono sempre ibridati sp 3, cioè si dice che gli elettroni di valenza si trovino in quattro orbitali equivalenti, derivati da una combinazione di orbitali 2s e tre orbitali 2p. Questi orbitali, aventi la stessa energia, sono disposti spazialmente sotto forma di un tetraedro, l'angolo tra loro cos -1 (- 1/3) ≈ 109,47 °. Lunghezze di legame e angoli di legame Una molecola di alcano ha solo legami singoli C-H e C-C. I primi sono una conseguenza della sovrapposizione dell'orbitale sp 3 del carbonio con l'orbitale 1s dell'idrogeno; Quest'ultimo è dovuto alla sovrapposizione di due orbitali sp 3 su atomi di carbonio diversi. Le lunghezze del legame sono 1,09 × 10 -10 m per il legame C-H e 1,54 × 10 -10 μm per il legame C-C. La disposizione spaziale dei legami è simile a quella dei quattro orbitali sp3: sono disposti in modo tetraedrico con un angolo di 109,47° tra di loro. Le formule strutturali che presentano i legami come ad angolo retto tra loro, sebbene generali e utili, non sono vere. Conformazione La formula strutturale e gli angoli di legame sono generalmente insufficienti per descrivere completamente la geometria di una molecola. Esiste un ulteriore grado di libertà per ciascun legame carbonio-carbonio: l'angolo di torsione tra gli atomi o i gruppi legati agli atomi a ciascuna estremità del legame. La disposizione spaziale descritta dagli angoli di torsione di una molecola è nota come forma. L'etano costituisce il caso più semplice per studiare la conformazione degli alcani, poiché esiste un solo legame C-C. Se guardi lungo l'asse del legame C-C, vedrai quella che viene chiamata proiezione di Newman. Gli atomi di idrogeno sia sugli atomi di carbonio anteriori che su quelli posteriori hanno tra loro un angolo di 120°, dovuto alla proiezione della base del tetraedro su un piano piatto. Tuttavia, l'angolo di torsione tra un dato atomo di idrogeno attaccato al carbonio anteriore e un dato atomo di idrogeno attaccato al carbonio posteriore può essere liberamente variato da 0° a 360°. Questa è una conseguenza della libera rotazione attorno ad un semplice legame carbonio-carbonio. Nonostante questa apparente libertà, sono importanti solo due conformazioni estreme: la conformazione a eclisse e la conformazione a gradino.  Modelli a sfera e doppia vite di due rotatori per etano Modelli a sfera e doppia vite di due rotatori per etano Le due conformazioni, note anche come rotameri, differiscono in energia: la conformazione sfalsata ha un'energia inferiore di 12,6 kJ/mol (più stabile) rispetto alla conformazione eclissata (meno stabile). Questa differenza di energia tra le due conformazioni, chiamata energia torsionale, è piccola rispetto all'energia termica di una molecola di etano a temperatura ambiente. Rotazione costante attorno al legame C-C. Il tempo necessario per la transizione di una molecola di etano da una conformazione sfalsata all'altra, che equivale alla rotazione di un gruppo CH3 di 120° rispetto all'altro, è dell'ordine di 10 -11 s.  Proiezioni di due conformazioni di etano: eclissato a sinistra, scacchiera a destra. Proiezioni di due conformazioni di etano: eclissato a sinistra, scacchiera a destra. Gli alcani superiori sono più complessi, ma basati su principi simili, con la conformazione antiperiplanare sempre favorita attorno a ciascun legame carbonio-carbonio. Per questo motivo, nei diagrammi e nei modelli gli alcani vengono solitamente rappresentati secondo uno schema a zigzag. La struttura effettiva differirà sempre in qualche modo da queste forme idealizzate, poiché le differenze di energia tra le conformazioni sono piccole rispetto all'energia termica delle molecole, poiché le molecole di alcani non hanno una forma strutturale fissa, indipendentemente da ciò che il modello può mostrare. Proprietà spettroscopiche Quasi tutti i composti organici contengono legami carbonio-carbonio e carbonio-idrogeno e quindi mostrano alcune delle caratteristiche degli alcani nei loro spettri. Gli alcani si distinguono per l'assenza di altri gruppi e, quindi, per l'assenza di altri aspetti spettroscopici caratteristici di vari gruppi funzionali, come -OH, -CHO, -COOH, ecc. Spettroscopia ad infrarossi La modalità di allungamento carbonio-idrogeno fornisce un forte assorbimento tra 2850 e 2960 cm -1, mentre la modalità di allungamento carbonio-carbonio assorbe da 800 a 1300 cm -1. I metodi di piegamento dell'idrogeno carbonio dipendono dalla natura del gruppo: i gruppi metilici mostrano bande a 1450 cm -1 e 1375 cm -1 , mentre i gruppi metilenici mostrano bande a 1465 cm -1 e 1450 cm -1 . Le catene di carbonio con più di quattro atomi di carbonio mostrano un debole assorbimento a circa 725 cm -1. Spettroscopia NMR Le risonanze protoniche degli alcani si trovano solitamente a δH = 0,5-1,5. Le risonanze del carbonio 13 dipendono dal numero di atomi di idrogeno legati al carbonio: δ C = 8-30 (primario, metile, -CH 3), 15-55 (secondario, metilene, -CH 2 -), 20-60 (terziario , Metin , C-H) e quaternario. La risonanza del carbonio-13 degli atomi di carbonio quaternari è caratterizzata da debolezza dovuta all'assenza dell'effetto Overhauser nucleare e da lunghi tempi di rilassamento, e può mancare in campioni deboli o campioni che non sono stati elaborati per un tempo sufficientemente lungo. Spettrometria di massaGli alcani hanno un'elevata energia di ionizzazione, mentre gli ioni molecolari solitamente hanno energie di ionizzazione deboli. La frammentazione può essere difficile da interpretare, ma nel caso degli alcani ramificati, la catena del carbonio viene preferibilmente scissa nei carboni terziari o quaternari a causa della relativa stabilità dei radicali liberi risultanti. Il frammento risultante dalla perdita di un gruppo metilico (M-15) è spesso mancante, e l'altro frammento è spesso separato da intervalli di quattordici unità di massa, corrispondenti alla perdita sequenziale dei gruppi CH2. Metodi per produrre alcaniPuoi anche imparare e studiare i metodi per ottenere gli alcani in questo articolo. DEFINIZIONE Alcani– idrocarburi saturi (alifatici), la cui composizione è espressa dalla formula C n H 2 n +2. Gli alcani formano una serie omologa, ciascun composto chimico differisce nella composizione dal successivo e dal precedente per lo stesso numero di atomi di carbonio e idrogeno - CH 2, e le sostanze incluse nella serie omologa sono chiamate omologhi. La serie omologa degli alcani è presentata nella Tabella 1. Tabella 1. Serie omologhe di alcani. Nelle molecole degli alcani si distinguono atomi di carbonio primari (cioè collegati da un legame), secondari (cioè collegati da due legami), terziari (cioè collegati da tre legami) e quaternari (cioè collegati da quattro legami). C 1 H3 – C 2 H 2 – C 1 H 3 (1 – atomi di carbonio primari, 2 – secondari) CH 3 –C 3 H(CH 3) – CH 3 (atomo di carbonio 3-terziario) CH 3 – C 4 (CH 3) 3 – CH 3 (atomo di carbonio quadriquaternario) Gli alcani sono caratterizzati da isomerismo strutturale (isomerismo dello scheletro del carbonio). Pertanto, il pentano ha i seguenti isomeri: CH 3 -CH 2 -CH 2 -CH 2 -CH 3 (pentano) CH 3 –CH(CH 3)-CH 2 -CH 3 (2-metilbutano) CH 3 -C(CH 3) 2 -CH 3 (2,2 – dimetilpropano) Gli alcani, a cominciare dall'eptano, sono caratterizzati da isomeria ottica. Gli atomi di carbonio negli idrocarburi saturi sono in ibridazione sp 3. Gli angoli tra i legami nelle molecole di alcani sono 109,5. Proprietà chimiche degli alcaniIn condizioni normali, gli alcani sono chimicamente inerti: non reagiscono né con acidi né con alcali. Ciò è spiegato dall'elevata forza dei legami C-C e C-H. I legami C-C e C-H non polari possono essere scissi omoliticamente solo sotto l'influenza di radicali liberi attivi. Pertanto, gli alcani entrano in reazioni che procedono mediante il meccanismo di sostituzione radicale. Nelle reazioni radicaliche, gli atomi di idrogeno vengono prima sostituiti con atomi di carbonio terziari, quindi con atomi di carbonio secondari e primari. Le reazioni di sostituzione radicalica hanno una natura a catena. Le fasi principali: nucleazione (inizio) della catena (1) - avviene sotto l'influenza della radiazione UV e porta alla formazione di radicali liberi, crescita della catena (2) - avviene a causa dell'estrazione di un atomo di idrogeno dalla molecola di alcano ; terminazione della catena (3) – si verifica quando due radicali identici o diversi si scontrano. X:X → 2X . (1) R:H+X . → HX + R . (2) R . + X:X → R:X + X . (2) R . +R . → R:R (3) R . +X . → R:X (3) X . +X . → X:X (3) Alogenazione. Quando gli alcani interagiscono con cloro e bromo sotto l'azione della radiazione UV o dell'alta temperatura, si forma una miscela di prodotti dagli alcani mono- e polialogeno-sostituiti: CH 3 Cl + Cl 2 = CH 2 Cl 2 + HCl (diclorometano) CH 2 Cl 2 + Cl 2 = CHCl 3 + HCl (triclorometano) CHCl 3 +Cl 2 = CCl 4 + HCl (tetracloruro di carbonio) Nitrazione (reazione di Konovalov). Quando l'acido nitrico diluito agisce sugli alcani a 140°C e a bassa pressione, si verifica una reazione radicalica: CH 3 -CH 3 +HNO 3 = CH 3 -CH 2 -NO 2 (nitroetano) + H 2 O Solfoclorurazione e solfossidazione. La solfonazione diretta degli alcani è difficile ed è spesso accompagnata da ossidazione, con conseguente formazione di cloruri di alcansolfonile: R-H + SO 2 + Cl 2 → R-SO 3 Cl + HCl La reazione di ossidazione solfonica procede in modo simile, solo in questo caso si formano acidi alcansolfonici: R-H + SO 2 + ½ O 2 → R-SO 3 H Cracking– scissione radicale dei legami C-C. Si verifica quando riscaldato e in presenza di catalizzatori. Quando vengono crackizzati gli alcani superiori, si formano gli alcheni; quando vengono crackati metano ed etano, si forma l'acetilene: C 8 H 18 = C 4 H 10 (butano) + C 3 H 8 (propano) 2CH4 = C2H2 (acetilene) + 3H2 Ossidazione. La lieve ossidazione del metano con l'ossigeno atmosferico può produrre metanolo, aldeide formica o acido formico. Nell'aria, gli alcani bruciano in anidride carbonica e acqua: C n H 2 n +2 + (3n+1)/2 O 2 = nCO 2 + (n+1)H 2 O Proprietà fisiche degli alcaniIn condizioni normali, C 1 -C 4 sono gas, C 5 -C 17 sono liquidi e, a partire da C 18, sono solidi. Gli alcani sono praticamente insolubili in acqua, ma sono altamente solubili in solventi non polari, come il benzene. Pertanto, il metano CH 4 (palude, gas di miniera) è un gas incolore e inodore, altamente solubile in etanolo, etere, idrocarburi, ma scarsamente solubile in acqua. Il metano viene utilizzato come combustibile ad alto contenuto calorico nel gas naturale, come materia prima per la produzione di idrogeno, acetilene, cloroformio e altre sostanze organiche su scala industriale. Il propano C 3 H 8 e il butano C 4 H 10 sono gas utilizzati nella vita di tutti i giorni come gas in bombole a causa della loro facile liquefazione. Il propano viene utilizzato come carburante per automobili perché è più ecologico della benzina. Il butano è la materia prima per la produzione di 1,3-butadiene, che viene utilizzato nella produzione di gomma sintetica. Preparazione degli alcaniGli alcani sono ottenuti da fonti naturali: gas naturale (80-90% - metano, 2-3% - etano e altri idrocarburi saturi), carbone, torba, legno, petrolio e cera di roccia. Esistono metodi di laboratorio e industriali per la produzione di alcani. Nell'industria gli alcani si ottengono dal carbone bituminoso (1) o dalla reazione Fischer-Tropsch (2): nC + (n+1)H 2 = C n H 2 n +2 (1) nCO + (2n+1)H 2 = C n H 2 n +2 + H 2 O (2) I metodi di laboratorio per la produzione di alcani comprendono: idrogenazione di idrocarburi insaturi mediante riscaldamento e in presenza di catalizzatori (Ni, Pt, Pd) (1), l'interazione dell'acqua con composti organometallici (2), elettrolisi di acidi carbossilici (3), mediante reazioni di decarbossilazione (4) e Wurtz (5) e in altri modi. R 1 -C≡C-R 2 (alchino) → R 1 -CH = CH-R 2 (alchene) → R 1 -CH 2 – CH 2 -R 2 (alcano) (1) R-Cl + Mg → R-Mg-Cl + H 2 O → R-H (alcano) + Mg(OH)Cl (2) CH3COONa↔ CH3COO — + Na + 2CH 3 COO - → 2CO 2 + C 2 H 6 (etano) (3) CH3COONa + NaOH → CH4 + Na2CO3 (4) R 1 -Cl +2Na +Cl-R 2 →2NaCl + R 1 -R 2 (5) Esempi di risoluzione dei problemiESEMPIO 1
Gli alcani o idrocarburi alifatici saturi sono composti con una catena aperta (non ciclica), nelle cui molecole gli atomi di carbonio sono collegati tra loro da un legame σ. L'atomo di carbonio negli alcani è in uno stato di ibridazione sp 3. Gli alcani formano una serie omologa in cui ciascun membro differisce per un'unità strutturale costante -CH 2 -, che è chiamata differenza omologa. Il rappresentante più semplice è il metano CH4.
Nomenclatura IUPAC I prefissi vengono utilizzati nei nomi degli alcani N-, secondo-, iso, ter-, neo:
La nomenclatura degli alcani ramificati si basa sulle seguenti regole fondamentali:
Va notato che per residui complessi (gruppi) moltiplicando i prefissi come bis-, tris-, tetrakis- altro.
Metodi di estrazione industriale 1. Estrazione dei gas alcani. Il gas naturale è costituito principalmente da metano e piccole miscele di etano, propano e butano. Il gas sotto pressione a basse temperature viene suddiviso in frazioni appropriate. 2. Estrazione di alcani dal petrolio. Il petrolio greggio viene purificato e lavorato (distillazione, frazionamento, cracking). Da prodotti trasformati si ottengono miscele o singoli composti. 3. Idrogenazione del carbone (metodo di F. Bergius, 1925). Il carbone duro o lignite in autoclavi a 30 MPa in presenza di catalizzatori (ossidi e solfuri di Fe, Mo, W, Ni) in un ambiente idrocarburico viene idrogenato e convertito in alcani, il cosiddetto carburante per motori: nC + (n+1)H2 = CnH2n+2 4. Ossintesi degli alcani (metodo di F. Fischer - G. Tropsch, 1922). Utilizzando il metodo Fischer-Tropsch si ottengono alcani dal gas di sintesi. Il gas di sintesi è una miscela di CO e H 2 con rapporti diversi. Si ottiene dal metano mediante una delle reazioni che avvengono a 800-900°C in presenza di ossido di nichel NiO supportato su Al 2 O 3: CH4 + H2O ⇄ CO + 3H2 CH4 + CO2 ⇄ 2CO + 2H 2 2CH4 + O2 ⇄ 2CO + 4H2 Gli alcani si ottengono dalla reazione (temperatura circa 300°C, catalizzatore Fe-Co): nCO + (2n+1)H2 → CnH2n+2 + nH2O La miscela risultante di idrocarburi, costituita principalmente da alcani della struttura (n = 12-18), è chiamata “sintina”. 5. Distillazione a secco. Gli alcani si ottengono in quantità relativamente piccole mediante distillazione a secco o riscaldamento di carbone, scisto, legno e torba senza accesso all'aria. La composizione approssimativa della miscela risultante è 60% idrogeno, 25% metano e 3-5% etilene. Metodi di estrazione in laboratorio 1. Preparazione da aloalchili 1.1. Reazione con sodio metallico (Wurz, 1855). La reazione consiste nell'interazione di un metallo alcalino con un alogenoalchile e viene utilizzata per la sintesi di alcani simmetrici superiori: 2CH 3 -I + 2Na ⇄ CH 3 -CH 3 + 2NaI Se alla reazione partecipano due diversi alogenoalchili, si forma una miscela di alcani: 3CH 3 -I + 3CH 3 CH 2 -I + 6Na → CH 3 -CH 3 + CH 3 CH 2 CH 3 + CH 3 CH 2 CH 2 CH 3 + 6NaI 1.2 Interazione con litio dialchil cuprati. Il metodo (a volte chiamato reazione E. Core - H. House) prevede l'interazione dei dialchil cuprati di litio reattivi R 2 CuLi con aloalchili. Innanzitutto, il litio metallico reagisce con un alogenoalcano in un ambiente etereo. Successivamente, il corrispondente litio alchilico reagisce con l'alogenuro di rame (I) per formare un dialchil cuprato di litio solubile: CH3Cl + 2Li → CH3 Li + LiCl 2CH 3 Li + CuI → (CH 3 ) 2 CuLi + LiI Quando tale litio dialchil cuprato reagisce con il corrispondente aloalchile, si forma il composto finale: (CH 3 ) 2 CuLi + 2CH 3 (CH 2 ) 6 CH 2 -I → 2CH 3 (CH 2 ) 6 CH 2 -CH 3 + LiI + CuI Il metodo consente di ottenere una resa in alcani pari quasi al 100% quando si utilizzano aloalchili primari. Con la loro struttura secondaria o terziaria la resa è del 30-55%. La natura del componente alchilico nel litio dialchil cuprato ha poco effetto sulla resa dell'alcano. 1.3 Riduzione degli aloalchili.È possibile ridurre gli aloalchili con idrogeno molecolare eccitato cataliticamente, idrogeno atomico, iodio, ecc .: CH 3 I + H 2 → CH 4 + HI (catalizzatore Pd) CH 3 CH 2 I + 2H → CH 3 CH 3 + HI CH 3 I + HI → CH 4 + I 2 Il metodo non ha valore preparativo, spesso viene utilizzato un forte agente riducente: lo iodio. 2. Preparazione da sali di acidi carbossilici. R-COONa ⇄ R-COO - + Na + All'anodo, l'anione dell'acido carbossilico viene ossidato, formando un radicale libero, e viene facilmente decarbossilato o eliminato dalla CO 2 . I radicali alchilici vengono ulteriormente convertiti in alcani a causa della ricombinazione: R-COO - → R-COO . +e- R-COO. →R. +CO2 R. +R. → R-R Il metodo preparativo di Kolbe è considerato efficace in presenza dei corrispondenti acidi carbossilici e nell'impossibilità di utilizzare altri metodi di sintesi. 2.2 Fusione di sali di acidi carbossilici con alcali. I sali di metalli alcalini degli acidi carbossilici, se combinati con gli alcali, formano alcani: CH 3 CH 2 COONa + NaOH → Na 2 CO 3 + CH 3 CH 3 3. Riduzione dei composti contenenti ossigeno(alcoli, chetoni, acidi carbossilici) . Gli agenti riducenti sono i composti sopra menzionati. Molto spesso viene utilizzato lo iodio, che è in grado di ridurre anche i chetoni: i primi quattro rappresentanti degli alcani dal metano al butano (C 1 -C 4) sono gas, dal pentano al pentadecano (C 5 -C 15 - liquidi, dall'esadecano (C 16) - sostanze solide.L'aumento del loro peso molecolare porta ad un aumento dei punti di ebollizione e di fusione, con alcani a catena ramificata che bollono a una temperatura inferiore rispetto agli alcani di struttura normale.Ciò è spiegato dalla minore interazione di van der Waals tra i molecole di idrocarburi ramificati allo stato liquido. Il punto di fusione degli omologhi con numeri pari è più alto rispetto alla temperatura, rispettivamente, di quelli dispari. Gli alcani sono molto più leggeri dell'acqua, non polari e difficili da polarizzare, ma sono solubili nella maggior parte dei solventi non polari, per cui possono essere essi stessi un solvente per molti composti organici. Categorie
|