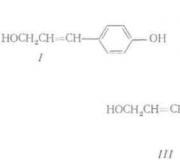
Proučavanje procesa termičke razgradnje skorodita i pirita. Promjena volumena čvrste faze produkata oksidacije pirita Ljekovita svojstva minerala
1U radu su prikazani rezultati termičke analize uzoraka monofrakcija skorodita (FeAsO4) i pirita (FeS2), kao i njihove mješavine u omjeru 3:1. Utvrđeno je da se toplinska dekompozicija skorodita odvija u tri faze, te su određeni temperaturni rasponi i toplinski učinci tih reakcija. Rezultati termičke razgradnje pirita pokazali su da se pirit raspada u dva stupnja na pirotin i malu količinu magnetita. Eksperimentalno je dokazano da se smjesa skorodita i pirita razgrađuje u dvije glavne faze, a prema rendgenskoj faznoj analizi konačni produkti razgradnje su pirotin i magnetit. Na temelju rezultata ovog istraživanja izradit će se preporuke za optimizaciju procesa prženja zlatonosne skoroditne rude s piritnim koncentratom u atmosferi pregrijane vodene pare.
toplinska analiza
ubrzava
pregrijana para
1. Markosyan S.M., Markosyan S.M., Antsiferova S.A., Timoshenko L.I. Metoda diferencijalne toplinske analize u ocjeni učinkovitosti obogaćivanja sulfidnih ruda // Suvremeni problemi znanosti i obrazovanja. – 2014. – Broj 3. URL: http://science-education.ru/ru/article/view id=13389.
2. Paleev P.L., Gulyashinov P.A., Gulyashinov A.N. Termodinamičko modeliranje dearzenacije buntovne rude zlata–kvarc–arsena u vodenoj pari // Journal of Mining Science. – 2016. – God. 52. – Broj 2. – Str. 373–377.
3. Gulyashinov P.A., Paleev P.L., Gulyashinov A.N. Studija procesa prženja skoroditne rude koja sadrži zlato // Bilten ISTU. – 2016. – T. 20, br. 10. – Str. 154–162.
4. Gzogyan S.R., Chanturia E.L. Utjecaj toplinskih učinaka na željezne sulfide i okside // Rudarski informativno-analitički glasnik. – 2010. – br. 5. – str. 63–69.
5. Čepuštanova T.A. Fizikalno-kemijska svojstva i tehnološke osnove za dobivanje pirotina iz pirita: dis. ...kand. tehn. Sci. – Alma-Ata, 2009. – 143 str.
Trenutno su praktički razrađena bogata i laka za preradu nalazišta ruda plemenitih i obojenih metala; osnova suvremene baze mineralnih resursa Ruske Federacije uglavnom se sastoji od teško preradivih siromašnih, fino diseminiranih i teško preradive rude. Ove rude uključuju rude zlata i arsena, što je zbog bliske povezanosti zlata s mineralima koji sadrže arsen. Takvo se zlato naziva nevidljivim jer se ne može detektirati optičkim metodama. Vatrostalne rude zahtijevaju preliminarnu obradu kako bi se postigla prihvatljiva razina iskorištenja zlata tijekom njihove naknadne cijanizacije. Sve metode predtretmana uključuju razbijanje mineralne matrice kako bi se oslobodilo zlato.
Toplinska analiza (kalorimetrija) je metoda za proučavanje fizikalnih i kemijskih procesa koja se temelji na bilježenju toplinskih učinaka koji prate transformaciju tvari u uvjetima temperaturnog programiranja. Ova metoda ima široku primjenu ne samo u analitičkoj kemiji, već iu geologiji za identifikaciju raznih minerala i stijena. Također treba napomenuti da je toplinska analiza prikladna za laboratorijska istraživanja, ne zahtijeva veliku količinu polaznog materijala i može se koristiti kao ekspresna metoda za proučavanje mineralnih sirovina. Ova metoda može biti posebno korisna za vatrostalne sirovine koje sadrže zlato (uključujući sulfid), zbog visokog intenziteta rada i složenosti analize analize.
Za potvrdu prethodno dobivenih rezultata termodinamičkog modeliranja i proračuna kinetičkih parametara pečenja skorodita, provedena su istraživanja termičke razgradnje skorodita i pirita (monofrakcija), kao i mješavine skorodita i pirita u omjeru 3: 1.
Materijali i metode istraživanja
Objekti istraživanja bili su: zlatonosna oksidirana skoroditna ruda nalazišta Kozlovskoye (Kalganska regija, Transbaikalska regija). Prema mineraloškoj analizi, ruda sadrži: kvarc - 54%, skorodit - 35%, feldspate i aluminosilikatne stijene - 11%. U ispitivanom uzorku rude vrijedne komponente su zlato (16,9 g/t) i srebro (52,5 g/t). Kao i nestandardni koncentrat pirita iz bivše tvornice volfram-molibdena (Zakamensk, Republika Burjatija). Prema kemijskoj analizi koncentrat pirita sadrži, %: Ukupan - 38,3, Fe - 35,8, SiO2 - 24,2, Pb - 0,81, Zn - 0,78. Koncentrat pirita može se koristiti kao sulfidizator kada se prži u atmosferi pregrijane vodene pare.
Toplinska analiza provedena je diferencijalnom termogravimetrijom (DTG) i diferencijalnom skenirajućom kalorimetrijom (DSC) pomoću uređaja za simultanu termičku analizu Netzsch STA 449 F1 Jupiter.
Termogrami su snimani u platinskim tiglicama u sljedećim uvjetima: atmosfera - argon, temperaturni raspon 20-1000 °C, način zagrijavanja - linearan, brzina zagrijavanja uzorka 10 °C/min, težina uzorka 15-20 mg. Tijekom procesa zagrijavanja promjene mase uzorka minerala koji se proučava (TG krivulja), brzine promjene mase (DSC krivulja), temperature (T), kao i toplinski učinci reakcija (J/g) bili su snimljeno.
Rezultati istraživanja i rasprava
Podaci analize prikazani na Sl. 1 pokazuju da se razgradnja skorodita odvija u 3 faze. DSC i TG krivulje pokazuju da u temperaturnom području 162-215 °C dolazi do gubitka mase (do 5,35%), uz apsorpciju značajne količine topline (-205,3 J/g). Što objašnjava gubitak vode iz skorodita:
FeAsO4. 2H2O → FeAsO4 + 2H2O. (1)
Na temperaturi od 466-488 °C, uz značajan gubitak mase (19,25%), odvija se proces razgradnje bezvodnog skorodita prema formuli
2FeAsO 4 → Fe 2 O3 + As 2 O5. (2)
Kada se uzorak zagrije iznad 550 °C, opaža se egzotermni maksimum (7,15 J/g), koji ukazuje na razgradnju As 2 O5:
As 2 O5 → As 2 O3 + O2. (3)
Prema XRF podacima, konačni produkt razgradnje skorodita je magnetit (Fe3O4).
Toplinsku razgradnju pirita dobro je opisao niz autora. Termogram prikazan na sl. 2, dobiven na uzorku monofrakcije pirita, pokazuje da se razgradnja pirita također odvija u 3 stupnja. U temperaturnom području od 491-549 °C dolazi do toplinske disocijacije pirita uz stvaranje elementarnog sumpora uz blagi gubitak mase uz endotermni učinak (-41,89 J/g):
2FeS 2 → 2FeS + S 2 . (4)
Daljnjim povećanjem temperature uočava se značajan endotermni vrh s najvećim gubitkom mase (16,19%), što se objašnjava daljnjom razgradnjom pirita prema ukupnoj reakciji:
4FeS 2 + 11O 2 → 2Fe 2 O3 + 8SO 2. (5)
Riža. 1. Termogram raspada skorodita

Riža. 2. Termogram razgradnje pirita

Riža. 3. Termogram raspadanja smjese skorodita i pirita

Riža. 4. Shema laboratorijske instalacije za pečenje u atmosferi pregrijane vodene pare: 1 - grijač; 2 - posuda s destiliranom vodom; 3 - reaktor; 4 - pećnica; 5 - čamac s rudom; 6 - kontrolna otopina; 7 - spremnik za hlađenje kontrolne otopine
Zbog nedostatka kisika vjerojatno će doći do sljedeće reakcije:
3FeS 2 + 8O 2 → Fe 3 O 4 + 6SO 2. (6)
Konačni proizvod razgradnje pirita je pirotin (FeS), kao i mala količina magnetita (Fe 3 O 4).
Od najvećeg interesa je termogram razgradnje smjese skorodita i pirita 3:1 (slika 3), u tom omjeru smjesa će se isporučivati na sulfidizirajuće prženje. Kada se dosegne temperaturni raspon od 153-197 °C, dolazi do gubitka mase (2,74%), uz apsorpciju značajne količine topline. Rezultirajući endotermni vrh ukazuje na gubitak vode iz skorodita.
TG i DSC krivulje pokazuju da se najveći gubitak težine (ukupno do 13,4%) događa na temperaturi od 450-590 °C, postoji i maksimalni endotermni vrh (-129,5 J/g), najvjerojatnije je da u tom rasponu temperatura dolazi do razgradnje skorodita i pirita, kao i do sulfidacije oslobođenog arsenovog oksida elementarnim sumporom. Krajnji produkti reakcija su magnetit (Fe3O4) i pirotin (FeS). Sav arsen se oslobađa u plinovitu fazu.
Kako bi se potvrdili rezultati termičke analize, provedena su eksperimentalna laboratorijska istraživanja za određivanje finalnih produkata prženja u atmosferi pregrijane vodene skoroditne rude i koncentrata pirita u “protočnom” laboratorijskom postrojenju (slika 4).
Ova laboratorijska instalacija sastoji se od četiri glavne komponente - električne peći, grijača, reaktora i posude s plinskim apsorberom. Temperatura u reaktoru mjeri se termoparovima tipa XA, a regulira mikroprocesorskim elektroničkim termostatom MPRT-22 koji je ugrađen za automatizaciju procesa loženja. Kada se postigne potrebna temperatura pečenja, u reaktor se dovodi pregrijana vodena para, zatim se u čamac od alunduma puni porcija skoroditne rude i koncentrata pirita težine od 2 do 3 g. Početak procesa pečenja smatra se trenutak kada je uveden dio naboja. Temperatura pečenja 700 °C, trajanje pečenja 25 minuta. Dobiveni pepeo podvrgnut je rendgenskoj faznoj analizi.
Na sl. Na slici 5. prikazan je rendgenski difraktogram dobivenih žarulja, pri čemu je utvrđeno da su nakon pečenja konačne faze koje sadrže željezo magnetit (Fe 3 O 4) i pirotin (FeS).
Tako su na temelju provedenih istraživanja utvrđeni temperaturni rasponi tijekom razgradnje proučavanih minerala, kao i prevladavanje endotermnih učinaka. Eksperimentalno je potvrđeno da pri pečenju mješavine skoroditne rude i koncentrata pirita u omjeru 3:1 (temperatura pečenja 700 °C, trajanje pečenja 25 minuta), u atmosferi pregrijane vodene pare, konačni produkt je magnetit ( Fe 3 O 4) i pirotin (FeS) .

Riža. 5. Rtg snimka pepela
Provedena su istraživanja termičke razgradnje monofrakcija skorodita i pirita u atmosferi argona. Određeni su temperaturni rasponi i toplinski učinci tijekom razgradnje monofrakcija skorodita, pirita i njihove smjese u omjeru 3:1. Prikazana je prevladavanje endotermnih učinaka tijekom razgradnje proučavanih minerala u inertnoj atmosferi. Rezultati ovog istraživanja pomoći će optimizirati proces prženja zlatonosne skoroditne rude s piritnim koncentratom u atmosferi pregrijane vodene pare.
Bibliografska poveznica
Gulyashinov P.A., Paleev P.L., Gulyashinov A.N. PROUČAVANJE PROCESA TERMIČKE RAZGRADNJE SKORODITA I PIRITA // International Journal of Applied and Fundamental Research. – 2017. – Broj 12-1. – Str. 22-27;URL: https://applied-research.ru/ru/article/view?id=11956 (datum pristupa: 19.09.2019.). Predstavljamo vam časopise izdavačke kuće "Akademija prirodnih znanosti"
Malo ljudi zna da su pirit i željezni pirit dva različita naziva za isti mineral. Ovaj kamen ima još jedan nadimak: "pseće zlato". Zašto je mineral zanimljiv? Koja fizička i magična svojstva ima? O tome će govoriti naš članak.
Željezni pirit: opće fizikalne karakteristike
Pirit (ne smije se brkati s peritom) je neproziran mineral s izraženim metalnim sjajem. Drugi korišteni nazivi su sumpor ili željezni pirit. Mineral može sadržavati nečistoće bakra, zlata, selena, kobalta, nikla i drugih kemijskih elemenata. Ne otapa se u vodi. Tvrdoća po Mohsovoj ljestvici: 6-6,5.
Formula željeznog pirita: FeS 2. Boja minerala je slamnato-žuta ili zlatna. Kamen iza sebe ostavlja tanku zelenkasto-crnu liniju. Kristali pirita su kubičnog oblika. Oni su velikodušno prekriveni plitkim ravnim utorima koji se nalaze paralelno jedan s drugim. pirit ima sljedeći oblik.
Riječ "pirit" je grčkog porijekla. Na ruski se prevodi kao "kamen koji gađa vatru". I ovo nije samo lijepa metafora: kada se udari, pirit zapravo iskri. Mineral se odlikuje magnetskim i vodljivim svojstvima, u vlažnom okruženju s obiljem kisika se raspada.
Rasprostranjenost u zemljinoj kori i glavna ležišta minerala
Željezni pirit jedan je od najčešćih sulfida na svijetu. Podrijetlo većine njegovih naslaga je hidrotermalno i sedimentno. Pirit nastaje u mulju dna zatvorenih mora, tijekom taloženja željeza sumporovodikom. Ponekad je prisutan iu magmatskim stijenama.

Velika nalazišta pirita otkrivena su u Rusiji, Kazahstanu, Španjolskoj, Italiji, SAD-u, Kanadi, Norveškoj i Japanu. U Rusiji se nalazišta ovog minerala nalaze na Altaju, Kavkazu, a također iu regiji Voronjež. Važno je napomenuti da je pirit vrlo rijetko predmet samostalnog rudarenja. Obično se vadi iz utrobe zemlje usput, tijekom razvoja vrjednijih minerala.
Primjena pirita u industriji
“Pseće zlato” ili “zlato budale” - tako je pirit dobio nadimak tijekom zlatne groznice. Kristali minerala svjetlucali su tako zavodljivo da su ga često pogrešno smatrali plemenitim metalom. Inače, na to su se opekli i španjolski konkvistadori još u 16. stoljeću. Dok su osvajali Novi svijet, s oduševljenjem su mamili "pseudo-zlato" od američkih Indijanaca.

Da budemo pošteni, vrijedi napomenuti da se željezni pirit doista može smatrati zlatom. Kristalna rešetka ovog minerala često sadrži čestice plemenitog metala. Međutim, oni su obično manji i ne mogu se izvući. Ipak, naslage pirita vrlo često ukazuju na prisutnost nalazišta zlata na određenom području.
Glavno područje primjene željeznog pirita danas je izrada nakita. Međutim, rijetko služi kao osnova za izradu nakita. Najčešće se od pirita izrađuju manji umeci za nakit od vrijednijih metala.
Kamen se koristi kao dodatak u proizvodnji cementa, ali i za proizvodnju sumporne kiseline. Zajedno s kristalima nekih drugih minerala koristi se i za izradu jednostavnih detektorskih radio-prijemnika. Zbog svoje sposobnosti da proizvodi iskre, pirit je ranije bio široko korišten u proizvodnji oružja.
Željezni pirit u magiji
Od davnina su ljudi s ovim mineralom postupali s velikim oprezom. Smatrao se "muškim" kamenom. Vjerovalo se da pirit može učiniti predstavnika jačeg spola još odlučnijim, hrabrijim i privlačnijim u očima dama.
Stari Grci su pirit smatrali kamenom rata i boga Marsa. Svaki ga je vojnik nosio sa sobom u vojne pohode i velike bitke. Željezni pirit štitio je ratnika od smrti i davao mu hrabrost u borbi. U mračnoj eri srednjeg vijeka, alkemičari su pokazali značajan interes za kamen.

U modernoj magiji, željezni pirit se koristi kao zaštitni amulet. Međutim, mineral mora biti netaknut i neoštećen, inače se nevolje ne mogu izbjeći. Opće je prihvaćeno da pirit jača san, popravlja raspoloženje i ublažava dugotrajnu depresiju.
Kamen je savršen za Strijelca i Škorpiona. Ostali znakovi zodijaka trebali bi se prema njemu odnositi s oprezom, osobito Rakovi.
Magnitogorsko državno tehničko sveučilište nazvano po. G.I. Nosova
Sadašnja jalovina iz postrojenja za preradu je fina mineralna masa koja se sastoji od približno tri četvrtine rudnih minerala, a ostatak su nemetalni minerali. . U rudnim mineralima prevladava sulfidna frakcija sastava: pirit – 95 – 98%; halkopirit - oko 1,5%; sfalerit – 2-2,5%. Svi rudni i nerudni minerali tehnološke skupine tekuće jalovine su u primarnom obliku, bez znakova oksidacije svoje površine. Zbrinjavanje jalovine obogaćivanja ima nekoliko pravaca. Najznačajniji smjer je dodatno izdvajanje najvrjednijih komponenti iz jalovine, ali velikotonažni otpad ostaje neiskorišten. Najzahtjevnije područje primjene jalovine može biti otvrdnjavanje smjesa za zatrpavanje, koje će u svojoj strukturi biti klasificirane kao. Svojstva ovakvih betona nisu dovoljno proučena u području utjecaja rudne komponente na svojstva betona.
Budući da je pirit glavna komponenta jalovine bakreno-sumporne rude, njegovo će daljnje ponašanje utjecati na svojstva temeljena na jalovini.
Iz literaturnih i referentnih izvora poznate su i općeprihvaćene sheme kemijskih reakcija oksidacije pirita.
Oksidacija pirita u kiseloj sredini odvija se prema ukupnoj reakciji (1):

Promjena mase i volumena krute faze u interakciji s vodom u stehiometrijskom omjeru različitih spojeva uključenih u sastav veziva može se izračunati pomoću metode A.V. Volženski.
Apsolutni volumeni tvari koje sudjeluju u reakcijama izračunati su pomoću molekulskih masa i gustoća polaznih tvari sustava.
Osnovni proračuni prikazani su u tablici. 1. Oni pokazuju da se apsolutni volumen krute faze dobivenih tvari povećava u odnosu na apsolutni volumen krute faze početnih reagensa. To se događa zbog smanjenja gustoće nastalih faza kao rezultat dodavanja hidratacijske vode ili oksidacije.
Istodobno, usporedba apsolutnih volumena početnog sustava i sustava koji je nastao tijekom interakcije s kemijskim otopinama omogućuje nam da primijetimo još jednu vrlo važnu točku. Tijekom reakcije apsolutni ukupni volumen smjese polaznih tvari manji je od apsolutnog ukupnog volumena nastalih tvari. Posljedično, kao rezultat reakcija s dodatkom vode i oksidacije, ne dolazi do kontrakcije (kontrakcije) sustava.
Proračuni pokazuju da procese oksidacije pirita prati značajno povećanje apsolutnih volumena čvrstih faza. Nedvojbeno, ova pojava u početku dovodi do punjenja pora u sustavu. Zatim do povećanja naprezanja širenja u sustavu otvrdnjavanja i njegovog kasnijeg uništenja.


Tijek procesa oksidacije pirita ovisi o vrsti i uvjetima izlaganja reagensima. Ponašanje pirita kada je izložen različitim oksidirajućim sredstvima prikazano je u tablici. 2. Rezultati pokazuju da kuhanje u vodi dovodi do otapanja materijala u količini od 1% i da se ista količina materijala fiksira u suhom ostatku nakon isparavanja otopine, a njihov zbroj je gotovo 100%. Posljedično, u kipućoj vodi u nedostatku kisika ne dolazi do oksidacije pirita.

Kuhanje u otopini kiseline i lužine dovodi do značajne oksidacije pirita. Masa početnog uzorka tretiranog otopinom sumporne kiseline smanjuje se za 10%, a suhi ostatak filtrata doseže 46% mase izvornog uzorka. Kuhanje u otopini lužine ne smanjuje težinu početnog uzorka, a suhi ostatak filtrata doseže 50%. U ovom slučaju ukupne mase taloga na filtru (početni uzorak nakon vrenja) i suhog ostatka filtrata znatno premašuju početnu masu, za 36% kada su izložene kiselini i za 51% kada su izložene lužini.
To ukazuje na pojavu značajnih oksidativnih procesa pod djelovanjem kiselina i lužina u tekućoj fazi na produkte otapanja pirita. To potvrđuju izračunati podaci o peterostrukom povećanju volumena čvrste faze tijekom oksidacije pirita s alkalijama (vidi tablicu 1).
Navedeno ukazuje na ograničena područja primjene piritne jalovine, odnosno područja koja isključuju oksidaciju pirita. Istovremena prisutnost kisika i vode može dovesti do promjena u piritu prema gore opisanoj shemi i, posljedično, do uništenja strukture materijala.
Stoga je pri projektiranju mikrobetonskih sastava potrebno voditi računa o povećanju volumena formiranih tvari reguliranjem volumena unutarnjih pora ili stvoriti radne uvjete koji isključuju mogućnost oksidacije pirita. Takve uvjete osiguravaju rudarske eksploatacije ispunjene nasipnom smjesom. Oni su najracionalniji i najprostraniji prostor za reciklažu jalovine.
Bibliografija
- Lowson R. Vodena oksidacija pirita pomoću molekularnog kisika. - Kem. rev.-1982.- V. 82 - Br. 5.- Str. 461-497.
- O utjecaju nekih čimbenika na sorpciju kalijevog butil ksantata sulfidnim mineralima / B.M. Koryukin, V.P. Kačalkov, V.A. Yatsenko, M.V. Aksenyushkina // Stvaranje naprednih tehnologija za preradu bakrenih i bakreno-cinkovih ruda: Coll. znanstveni tr. - Sverdlovsk: izd. “Unipromed”, 1987. – str. 97-104.
- Kemijska svojstva anorganskih tvari: Udžbenik. priručnik za sveučilišta / Lidin R.A., Molochko V.A., Andreeva L.L. – M.: Kolos, 2003. – 480 str.
- Volženski A.V. Veziva. – M.: Viša škola, 1986.- 464 str.
Vidi također: